重慶市對申請新辦保健食品生產許可和國產保健食品備案實行聯動辦理
2024-11-07
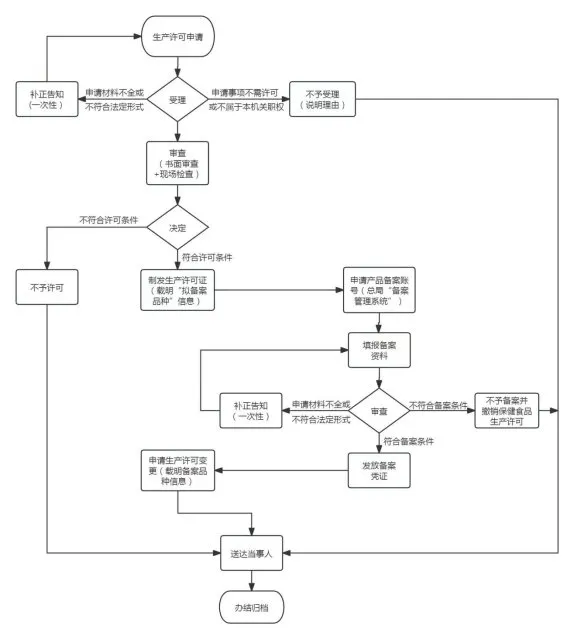
根據《食品生產許可管理辦法》(國家市場監督管理總局令第24號)、《保健食品注冊與備案管理辦法》(國家食品藥品監督管理總局令第22號)及《食品生產許可審查通則(2022版)》、《保健食品生產許可審查細則》、《保健食品備案工作指南(試行)》相關規定,重慶市市場監管局對申請新辦保健食品生產許可和國產保健食品備案兩個事項實行聯動辦理。現就有關事項公告如下:
一、申請人為在本市注冊登記的企業(含已取得普通食品生產許可的企業),具備保健食品生產條件,符合《保健食品生產許可審查細則》要求;申請的保健食品“擬備案品種”屬于國產保健食品備案范圍。申請人不符合上述條件的,不適用本公告的有關規定。
二、申請人通過線上(重慶政務服務網“渝快辦”—“保健食品生產許可新辦”)或者線下(市市場監管局一樓行政許可受理窗口)提交保健食品生產許可新辦申請材料,其中“保健食品注冊證明文件或備案證明”需提交“以‘擬備案品種’申請保健食品生產許可的情況說明”,“與保健食品生產許可事項有關的其他材料”需提交“擬備案品種”相關材料。
三、市市場監管局對申請材料齊全、符合法定形式的,予以受理;申請材料不齊全或者不符合法定形式的,一次性告知申請人需要補正的相關材料。市市場監管局在10個工作日內完成保健食品生產許可技術審查(包括書面審查和現場核查)和行政審批,對通過生產許可審查的申請人,作出準予保健食品生產許可的決定,制發載有“保健食品”類別的食品生產許可證,《食品生產許可品種明細表》中載明“擬備案品種”信息。申請人在取得《國產保健食品備案憑證》前不得生產該品種保健食品。
四、申請人獲得載明“擬備案品種”信息的食品生產許可證后,登錄市場監管總局“保健食品備案管理信息系統”(網址:https://xbjspba.gsxt.gov.cn/record_pt/index.jsp ),獲取登錄賬號,按照要求提交國產保健食品備案相關材料。市市場監管局收到備案材料后,經審查符合要求的,發放保健食品備案號和《國產保健食品備案憑證》。
五、申請人獲得《國產保健食品備案憑證》后,向市市場監管局提出保健食品生產許可變更申請。市市場監管局在7個工作日內完成生產許可變更審查(生產條件未發生變化的,不再進行現場核查),對通過生產許可變更審查的申請人作出準予變更的決定,頒發變更后的食品生產許可證,在其《食品生產許可品種明細表》載明已備案保健食品品種信息。
特此公告。
重慶市市場監督管理局
2024年11月5日
聯動辦理保健食品生產許可和
國產保健食品備案流程圖